11 月 30 日,國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)最新公示,上??茲扑幍?CT053 全人抗 BCMA 自體 CAR-T 細胞注射液擬納入突破性療法,用于治療復發(fā)難治多發(fā)性骨髓瘤。
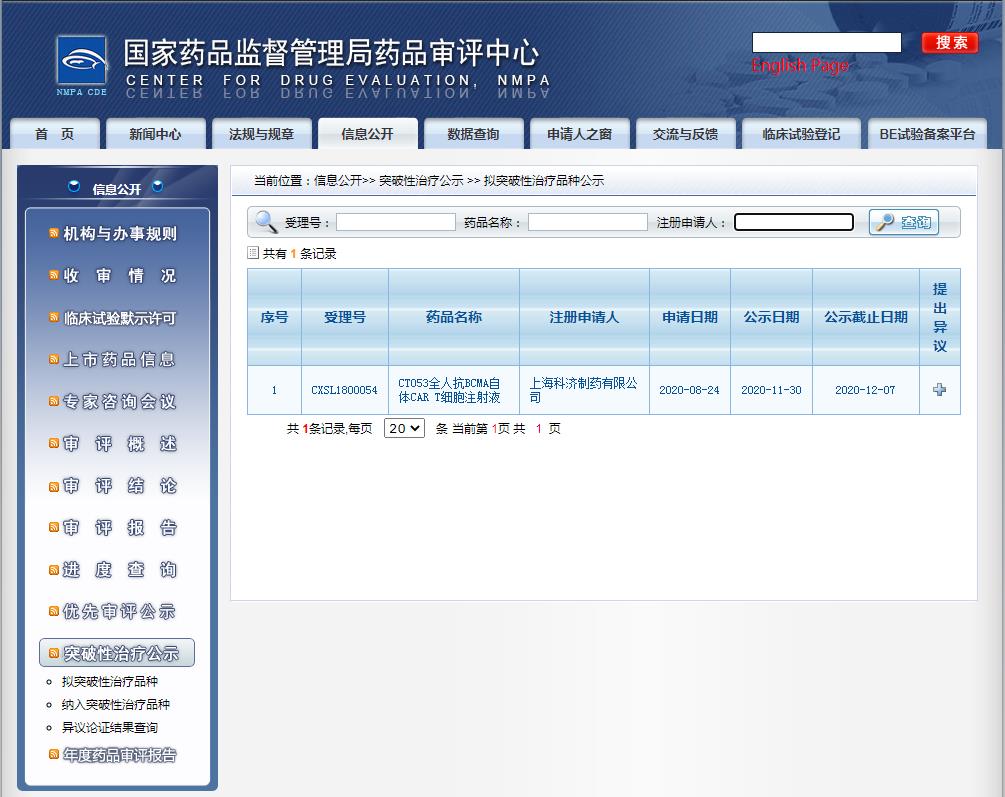
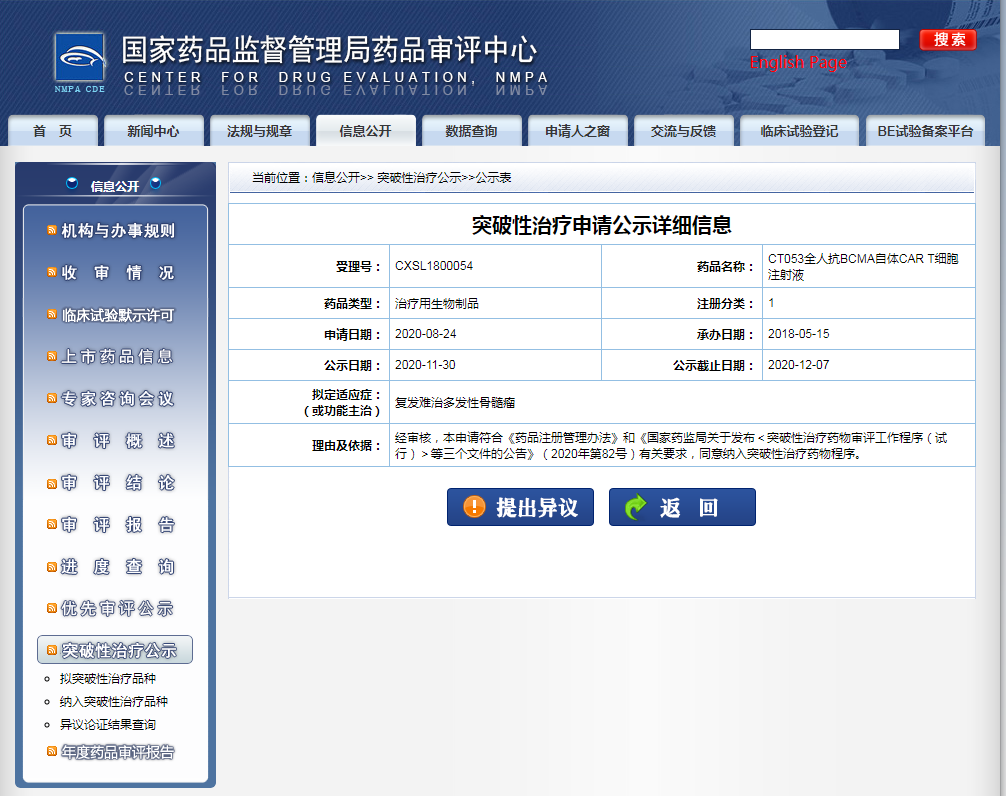
截圖來源:CDE官網(wǎng)
這是第 3 個擬納入突破性療法的 CAR-T 產(chǎn)品,與此前納入突破性療法的傳奇生物 LCAR-B38M 同樣靶向 BCMA。
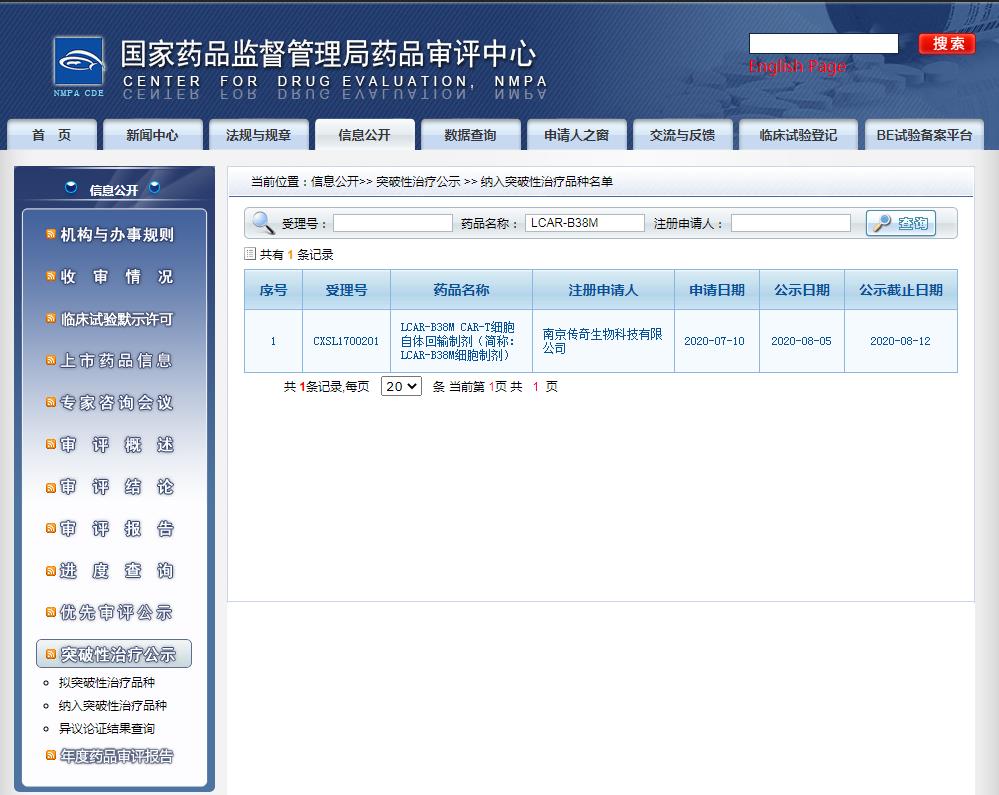
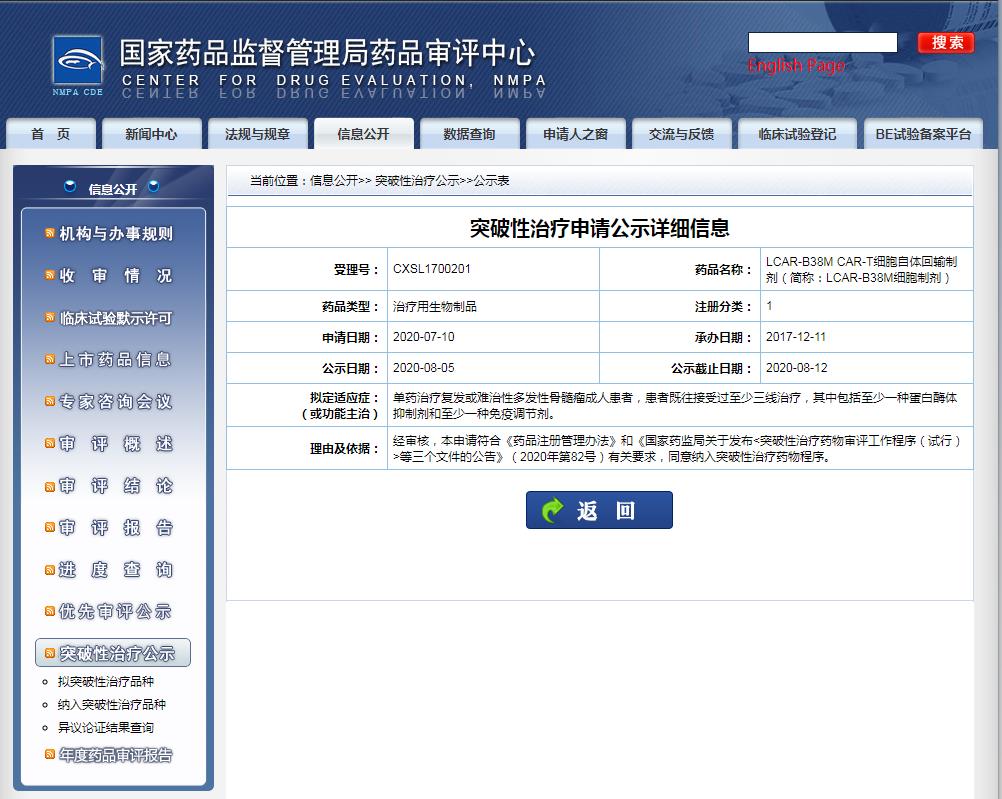
截圖來源:CDE官網(wǎng)
CT053 是科濟生物開發(fā)的全人抗 BCMA 的 CAR-T 細胞產(chǎn)品,用于復發(fā)難治多發(fā)性骨髓瘤。目前,該藥在國內正處于 I/II 期臨床階段(CTR20190955)。
截圖來源:CDE官網(wǎng)
多發(fā)性骨髓瘤是一種克隆性漿細胞異常增殖的惡性疾病,復發(fā)/難治多發(fā)性骨髓瘤(R/R MM)有重大的未滿足的醫(yī)學需求。B 細胞成熟抗原(BCMA)靶向的嵌合抗原受體CAR)基因工程修飾的 T 細胞,被認為是一種治療多發(fā)性骨髓瘤的新手段。本次科濟的 CT053 擬納入突破性療法,將獲得CDE 更多的臨床指導和溝通交流機會,加速其臨床開發(fā)。

截圖來源:CDE官網(wǎng)
此前被納入突破性療法的傳奇生物/強生合作開發(fā)的 LCAR-B38M / JNJ4528 同樣是靶向 BCMA。該藥進展快于 CT053,目前已啟動 全球隨機 3 期臨床試驗( CARTITUDE-4)。此外,同靶點 CAR-T 產(chǎn)品中,BMS/藍生物的 idecabtagene vicleucel (ide-cel,bb2121) 也是競爭者。
