2021年5月17日,上海瓔黎藥業(yè)有限公司(以下簡稱“瓔黎藥業(yè)”)宣布,公司自主研發(fā)的創(chuàng)新藥PI3Kδ選擇性抑制劑林普利司片(代號:YY-20394)新藥上市申請(NDA)已獲得國家藥品監(jiān)督管理局(NMPA)藥品審評中心(CDE)正式受理,受理編號:CXHS2101013,擬用于治療復(fù)發(fā)/難治濾泡性淋巴瘤。

圖片來源:CDE
據(jù)恒瑞醫(yī)藥公告,林普利司是瓔黎藥業(yè)研發(fā)的1類創(chuàng)新藥。
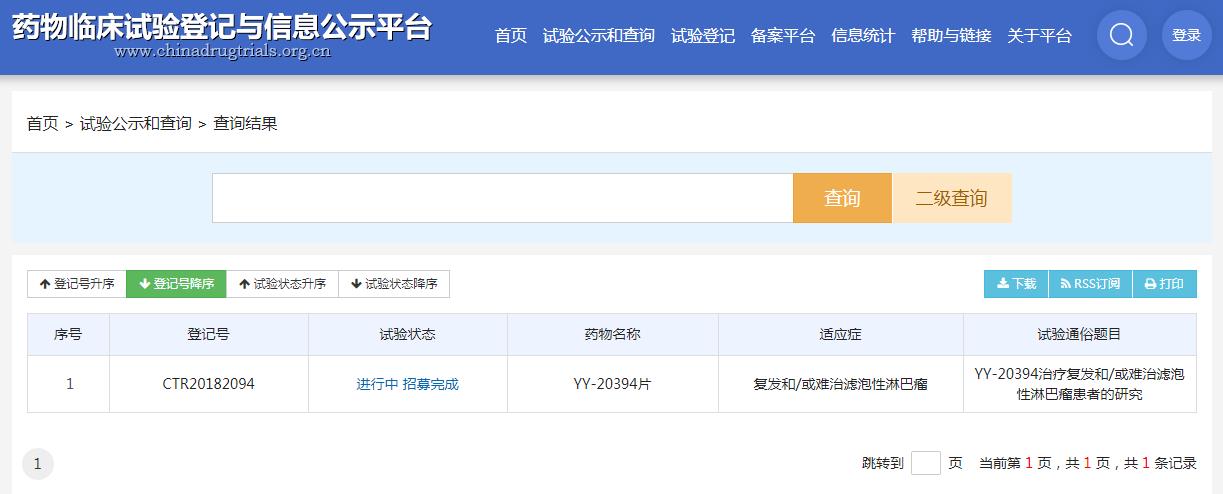
圖片來源:藥物臨床試驗登記與信息公示平臺
2018年10月,林普利司獲得了美國FDA兩項孤兒藥資格的授予(CLL/SLL, FL)。林普利司此前已在中國和美國開展了?項臨床試驗。2020年5月,獲準(zhǔn)在美國開展II期臨床研究;2021年3月30日,瓔黎藥業(yè)宣布,林林普利司在中國開展的一項針對復(fù)發(fā)/難治濾泡型淋巴瘤患者的II期注冊臨床試驗(YY-20394-002 )取得積極結(jié)果。
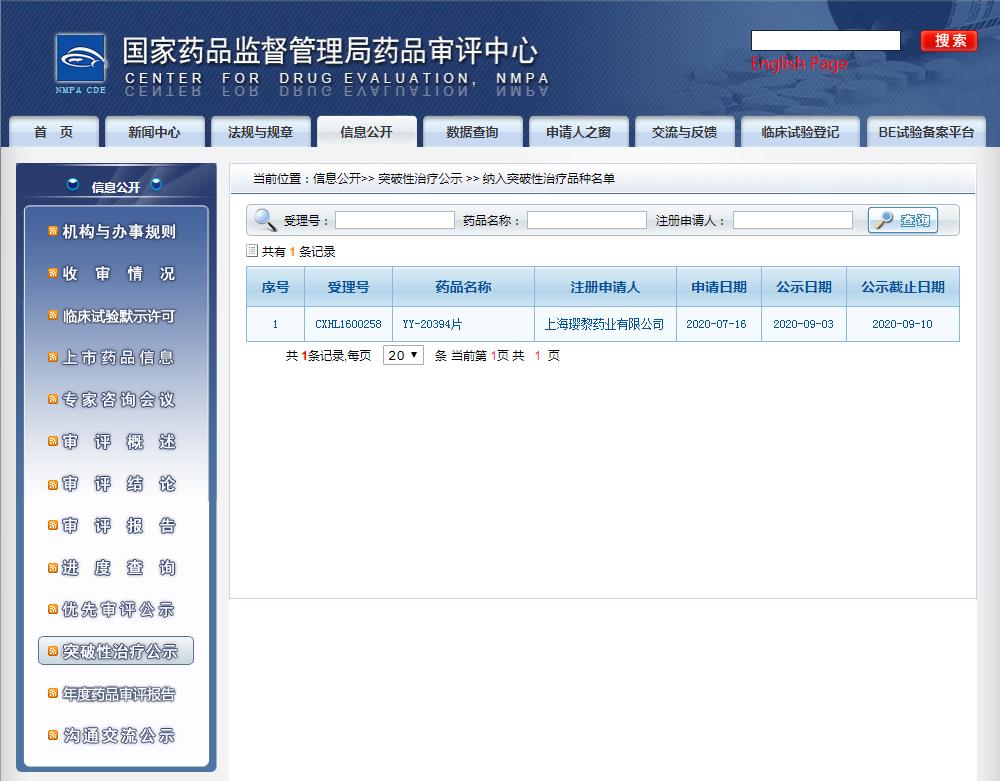
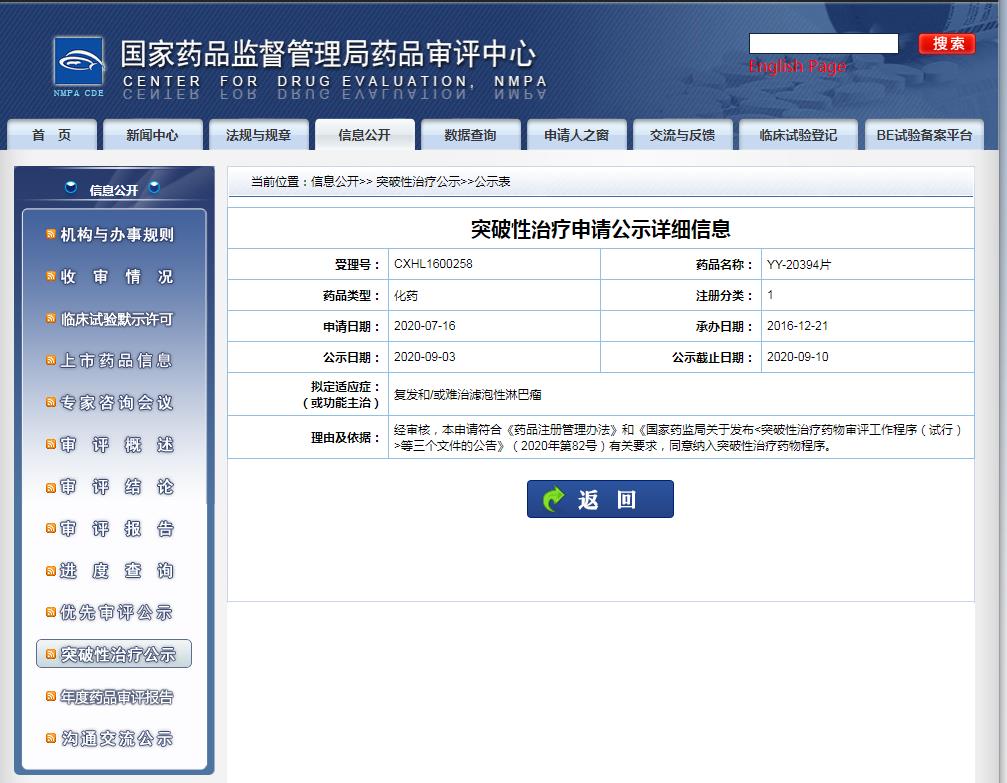
圖片來源:CDE
2020年9月,獲得中國國家藥品監(jiān)督管理局(NMPA)突破性療法認(rèn)定,用復(fù)發(fā)和/或難治濾泡性淋巴瘤。
在國內(nèi),還沒有同靶點的上市藥物。目前已經(jīng)有兩款藥物獲得了CDE優(yōu)先審評資格,分別為Copanlisib和度恩西布,拜耳靜脈注射用PI3K抑制劑Copanlisib于3月10日在國內(nèi)申報上市,石藥集團引進的PI3K-δ和PI3K-γ口服雙重抑制劑度恩西布于4月21日在國內(nèi)申報上市。
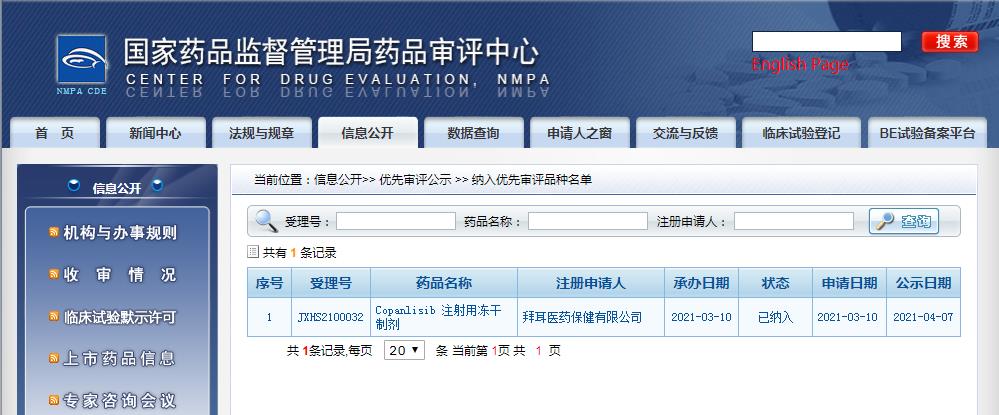
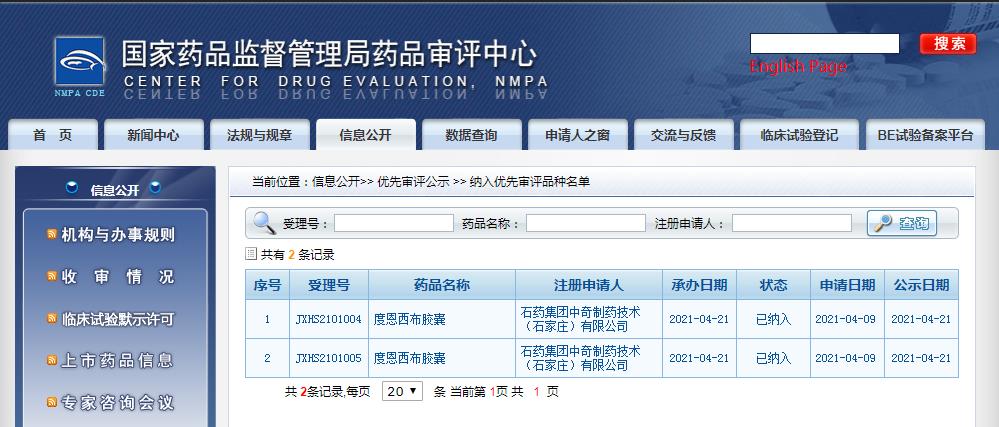
圖片來源:CDE
作為一款即將獲批上市的PI3Kδ高選擇性抑制劑,林普利司片將有望為國內(nèi)濾泡性淋巴瘤患者帶來新的治療選擇。
